|
|
TP-03已于2023年7月获得美国FDA批准上市,是目前FDA批准的首款也是唯一一款针对蠕形螨睑缘炎的药物;# e6 T. c/ W; d
TP-03在美国开展的用于治疗蠕形螨导致的睑板腺功能障碍的II期临床研究显示出了阳性的顶线结果;
5 @$ N% c$ `6 L" K TP-03在中国已完成用于治疗蠕形螨睑缘炎的III期临床研究,证明TP-03在治疗蠕形螨睑缘炎方面疗效显著且耐受性、安全性良好。
/ V% R9 P4 C9 K T  ( \1 h$ g. e7 l- a) l( k ( \1 h$ g. e7 l- a) l( k
近日,远大医药(0512.HK)与联拓生物科技有限公司(联拓生物)和Tarsus Pharmaceuticals, Inc. (Tarsus)达成产品引进战略合作协议。在相关条件获得满足后,公司将以1,500万美元的首付款及一定金额的注册里程碑费用为代价取得用于治疗蠕形螨睑缘炎及蠕形螨导致的睑板腺功能障碍的全球创新眼用制剂TP-03在大中华区(中国大陆、中国香港、中国澳门、中国台湾)的独家开发、生产及商业化权益。此次战略合作将深化远大医药在眼科领域的产品布局。
/ A5 B9 O( C7 x3 x* W TP-03已获FDA批准上市,未来有望填补国内临床空白) e) F2 ^1 b" }( W
关于TP-03及其临床试验: i2 k |7 e4 p; c# J3 N a% p2 [
TP-03是一款对γ-氨基丁酸门控氯离子通道(GABA-Cl)具有选择性的非竞争性拮抗剂,其通过选择性抑制蠕形螨体内的GABA-Cl,使虫体麻痹和死亡,进而彻底治愈蠕形螨睑缘炎。此外,TP-03具有高度亲脂性,可促进其在螨虫栖息的睫毛毛囊油脂中的吸收。
0 ?/ u; g% R2 i( C# O9 y( k TP-03已在美国完成了两项关键性临床研究,共入组800余名蠕形螨睑缘炎患者,根据临床结果显示,两项研究均达到了主要终点和所有次要终点,具有统计学意义,且未发生与治疗相关的严重不良事件。该产品已于二零二三年七月获得美国食品药品监督管理局(FDA)批准上市,是目前FDA批准的首款也是唯一一款针对蠕形螨睑缘炎的药物。此外,TP-03在美国开展的用于治疗蠕形螨导致的睑板腺功能障碍的II期临床研究也显示出了阳性的顶线结果。
9 R4 X* v! f+ A1 N2 q; j 中国注册方面,TP-03已完成了III期临床研究,根据研究结果显示,与对照组相比,TP-03治疗蠕形螨睑缘炎患者的蠕形螨感染根除率具有统计学显著性(p<0.001),眼睑袖套状分泌物治愈率也呈现出阳性但无统计学意义的趋势(p=0.15)。此外,TP-03耐受性良好,其安全性特征与其它大规模临床试验中观察到的结果相似,无治疗相关的停药情况。本次交易完成后,公司将大力推进TP-03在中国的注册落地工作,尽早惠及广大蠕形螨睑缘炎患者。
5 q* f! A* D* s' a6 w6 F& h0 E 关于蠕形螨睑缘炎" S& [2 q1 F7 p/ @# h/ M
睑缘炎是一种常见的眼科疾病。蠕形螨睑缘炎是蠕形螨感染睑缘所致的慢性炎性反应性疾病,约占所有睑缘炎病例的三分之二以上,主要累及睑缘皮肤、睫毛囊和腺体以及睑板腺,以眼痒、眼异物感、眼干、睑缘充血、鳞屑及睫毛根部袖套状分泌物等为典型临床表现,严重者可引起结膜及角膜并发症,且该病可能具有一定的传染性。
$ m: @' W, z; p) A6 V! w! C 此外,蠕形螨也是睑板腺功能障碍的危险因素之一,蠕形螨导致的睑板腺功能障碍患者常出现眼睑边缘发炎和视力模糊,并可能导致睑板腺堵塞和/或睑脂液分泌的减少,若不及时接受治疗,可能会导致泪膜永久性改变和进行性腺体丧失。据统计,目前中国有超过4,000万蠕形螨睑缘炎患者和超过7,000万MGD患者,患者人群庞大。中国目前并未有针对蠕形螨睑缘炎的药物上市,临床上急需一款起效快且可直接针对病因的安全有效的治疗药物,TP-03则有望填补该临床空白。
. l9 |& k, H& h# O& `2 F 布局全球创新产品,夯实五官科领域行业地位
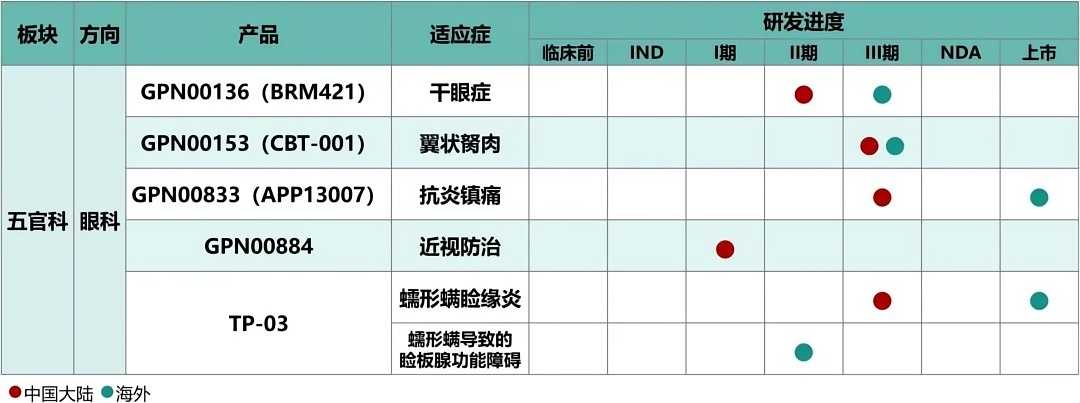
3 U) }+ q, A: `) J5 {# D1 Z& W 远大医药作为中国主要的五官科药物研发、生产及销售综合企业之一,在售产品管线数量位居行业前列,治疗领域覆盖眼科、耳鼻喉科、口腔科等多科室疾病,覆盖了化学制剂、中药制剂及健康产品,包含处方药、OTC、器械、消费品等几大类别,院内院外全渠道覆盖,打造集“预防+治疗+保健”为一体的“大五官生态圈”。创新研发方面,储备了治疗“近视”、“干眼症”、“翼状胬肉”和“眼科术后抗炎镇痛”的多款全球创新产品,且在2023年内均取得了重大研发进展。# {( Y0 U4 v$ |, O, c8 h
 8 T/ N/ S9 [. q& l, [ 8 T/ N/ S9 [. q& l, [
其中,治疗翼状胬肉的创新产品CBT-001于2023年3月获批在中国开展III期临床研究;治疗干眼症的小分子多肽药物GPN00136 (BRM421)于2023年4月获批在中国开展II期临床研究;用于抗炎镇痛的激素纳米混悬滴眼液GPN00833于2023年10月完成中国III期临床试验的首例患者入组给药,海外注册方面,该产品已于2024年3月获得美国FDA批准上市;用于推迟儿童近视进展的全球创新眼科药物GPN00884于2024年3月获批在中国开展I期临床研究。
# F0 f& T4 S) [. @2 Z0 p 未来,远大医药眼科板块将秉持中西联合和药械同治的发展战略,不断强化行业影响力,实现业务领域新突破。
% R2 e I) P4 ~7 F4 M( _ 远大医药集团有限公司董事会表示:“本集团一直高度重视创新产品和先进技术的研发,未来将持续加大对全球创新产品和先进技术的投入,丰富和完善产品管线及产业布局,坚持‘全球化运营布局,双循环经营发展’策略,充分发挥本集团的产业优势和研发实力,快速将科技创新产品落地上市,为全球患者提供更先进更多样的治疗方案。”
* ]% {) ?5 o& D( O* D& F6 p2 l: e( i: C. g( @
|
|